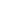文献解读|自激活的光-胞外囊泡用于协同三模态抗癌治疗
细胞外囊泡(EVs)是细胞衍生出的膜结构囊泡,如外泌体、微囊泡和凋亡小体等。由于在囊泡腔内包裹着或在颗粒表面修饰着丰富的成分,EVs在治疗各类危及生命的疾病方面有巨大潜力。通常情况下,源于免疫细胞外泌体对肿瘤表现出不同的免疫治疗效果。另外,由于其天然独特的特性,EVs在药物递送方面表现出卓越的性能,包括但不限于固有稳定性、生物膜透性、低免疫原性和归巢能力。前人研究证明,装载阿霉素的外泌体对乳腺癌细胞有靶向细胞毒性作用,且与游离药物相比,心脏毒性和副作用更小。另外一个研究表明,装载紫杉醇的外泌体对多药耐药肺癌有良好的治疗效果。外泌体甚至能够通过血脑屏障递送药物,为神经系统疾病提供了可能的解决方案。除了有效的体内外实验结果外,将外泌体作为药物载体有着巨大的转化潜力。源于间充质干细胞的外泌体装载KRAS G12D siRNA后对胰腺癌的治疗效果正进行Ⅰ期研究。尽管前景广阔,但它们距离全面临床转化阶段还很远。一个最重要的原因就是大多数EVs由于其纳米直径被保留在网状内皮系统中,然后被单核巨噬细胞和其他细胞吸收。为了提高药物递送精度和减少副作用,在目标组织处通过EVs释放特定药物非常可取,但具有挑战性。
在过去的几十年里,光动力疗法(PDT)由于其突出的优势,已成为癌症治疗的新模式,比如时空可控性、最小侵入性、高效性和低毒性。该疗法已被证实对多种有效,且目前几种光敏剂已被美国食品和药物管理局批准用于治疗某些癌症。此外,该疗法与其他治疗方法结合,可进一步提高治疗效果(比如光热疗法、放射疗法、免疫疗法和基因疗法)。PDT与PDL-1检查点阻断免疫疗法的协同作用,不仅可以消除原发性肿瘤,而且可以触发系统性的肿瘤特异性细胞毒性T细胞反应,从而完全抑制未治疗的转移瘤。即便如此,PDT对深部肿瘤的治疗效果受到激发光透性差、效率低的严重影响。作为一个有吸引力的替代方案,光敏剂通过原位化学反应产生化学能的激发不受透性的限制。Yu等通过构建基于化学发光共振能量转移的仿生纳米反应器,制定的光动力-饥饿协同治疗策略对深部转移瘤表现出良好的治疗效果。然而,由于化学能通常是H2O2与过氧草酸酯衍生物反应产生的,此类化学激发PDT严重依赖于过氧化氢。尽管与正常组织相比,肿瘤微环境中的H2O2水平升高,但持续的反应会迅速耗尽肿瘤组织局部的H2O2供应,PDT的治疗效果将明显受限。为了提高化学激发的PDT效率,需要在肿瘤微环境中充分补充H2O2。然而,H2O2增强剂的可靠性以及增强剂与光敏剂(PSs)共同递送到肿瘤的有效策略仍然十分有限。
该研究构建了自激活自发光的EVs递送系统,同时展示三种协同抗癌治疗模式。源于M1巨噬细胞的EVs(M1 EVs)和双[2,4,5-三氯-6-(戊氧羰基)苯基]草酸酯(CPPO),二氢卟酚e6(Ce6)共同孵育后,用多柔比星原药aldoxorubicin(Dox-EMCH)进行电转化,以获得装载CPPO、Ce6和Dox-EMCH的EVs(M1CCD)。系统给药后,由于M1 EVs天然的靶向能力,制备的M1CCD在肿瘤中不断积累,而M1 EVs有效地将促肿瘤的M2巨噬细胞重新诱导为抗肿瘤的M1巨噬细胞,不仅表现出免疫治疗活性,而且产生H2O2。CPPO与增多的H2O2反应,产生的化学能在没有光激发的情况下直接激活光敏剂Ce6,产生用于成像的化学发光和用于PDT的单线态氧(1O2)。与此同时,由1O2引起的膜破裂导致前药Dox-EMCH释放,随后在酸性微环境中被迅速激活转化为毒性阿霉素(Dox),并渗透到肿瘤深部的低氧组织。免疫疗法,光动力疗法和化学疗法的协同作用产生了强大的抗癌效果和较小的副作用。这种智能工程化的EV递送系统作为癌症治疗候选方案非常有前景。
基本信息

题目:Self-Activatable Photo-Extracellular Vesicle for Synergistic Trimodal Anticancer Therapy
期刊:ADVANCED MATERIALS
影响因子:27.398
PMID:33432702
通讯作者:谢海燕
作者单位:北京理工大学
索莱宝合作产品:
|
产品名称 |
产品货号 |
|
Hydrogen Peroxide(H2O2) Assay Kit |
BC3590 |
|
Hydrogen Peroxide(H2O2) Assay Kit |
BC3595 |
|
Calcein-AM/PI活细胞/死细胞 双染试剂盒 |
CA1630 |
摘 要
细胞外囊泡(EVs)在疾病治疗和药物递送方面都具有巨大潜力。然而,准确地从细胞外囊泡释放药物,以及细胞外囊泡和药物在目标组织处的自发治疗效果协同作用仍然具有挑战性。本研究报道了一种工程化的自激活光-EV,用于协同三模式抗癌治疗。M1巨噬细胞衍生的细胞外囊泡(M1 EVs)同时装载CPPO,Ce6和Dox-EMCH。给药后,由于M1 EVs的肿瘤归巢能力,制备的该系统可主动靶向肿瘤,其中M1 EVs将M2重新极化为M1巨噬细胞,不仅显示出免疫疗法的作用,而且进一步提高肿瘤微环境中的H2O2。H2O2和CPPO之间发生反应,产生化学能,激活Ce6,产生用于成像的化学发光和用于PDT的1O2。同时,由1O2引起的膜破裂导致Dox-EMCH释放,被释放的Dox-EMCH随后被特异性激活并渗透到肿瘤的低氧组织。免疫疗法,光动力疗法和化学疗法的协同作用可产生有效的抗癌功效,显示出抗击癌症的巨大希望。
研究内容及结果
1. M1CCD具有自激活化学发光和1O2生成能力

小鼠原始腹腔巨噬细胞首先用1ug/mL脂多糖(LPS)处理24小时极化形成M1巨噬细胞,通过流式细胞术确定极化效果。随后用经验证的超速离心程序纯化M1 EVs。EVs的磷脂双分子层通过疏水作用将CPPO和Ce6包裹起来,形成的亲水管腔装载水溶性的Dox-EMCH。为了装载尽可能多的药物,首先,作者分别研究了M1 EVs(约1010细胞颗粒mL-1)中CPPO、Ce6和Dox-EMCH的装载能力,发现装载饱和浓度分别为100、160和250 ug/mL。然后将相同数目的M1 EVs(约1010细胞颗粒mL-1)用100 ug/mL的CPPO和160 ug/mL的Ce6孵育,用250 ug/mL的Dox-EMCH进行电转化。通过CPPO、Ce6和Dox-EMCH紫外吸收光谱的特征吸收峰及其标志物的荧光成像效果验证这些药物是否成功装载(图2a,b)。每1×1010M1 EVs颗粒(n=6)CPPO、Ce6和Dox-EMCH的装载量分别为16.7±0.8,5.4±0.3,12.7±0.5ug。与原始M1 EVs相似,M1CCD的形态为典型的杯状(图2c),且装载药物后其Zeta电位几乎不变。M1CCD的水动力学尺寸为165±31nm(n=6),与原始M1 EVs相比增加了约36nm。M1CCD可在盐酸盐缓冲液(PBS)或10%胎牛血清中保存一周,显示出良好的稳定性(图2d,e)。
为实现化学激发的光动力疗法,有必要确定光敏剂的分子最高占据轨道(HOMO)与化学激发源的分子最低占据轨道(LUMO)间的电子转移。对M1CCD来说,Ce6为光敏剂,CPPO与H2O2反应的中间产物1,2-二氧杂环丁烷二酮为化学激发源。通过Gaussian 09计算,Ce6的分子最高占据轨道能和1,2-二氧杂环丁烷二酮的分子最低占据轨道能分别为-5.23和-3.20eV。这个2.03eV的能量差足够CPPO直接激发Ce6,反应产生化学荧光(图2f)。在H2O2存在的情况下,不同形式M1 EV化学荧光图像表明M1 EVs、装载CPPO的M1 EVs(M1@CPPO)和装载Ce6的M1 EVs几乎都没有这种荧光信号。然而,M1CCD和同时装载CPPO、Ce6的M1 EVs(M1CC)可以产生特定化学荧光,这证实Ce6只有在CPPO和H2O2的作用下才可以被激发。在M1CCD一定的情况下,化学荧光强度与H2O2浓度呈现出良好的线性关系。因此,这能够用于追踪小鼠腹膜炎不同发展阶段的情况。同时,受激发的Ce6通过系统间交叉(ISC)将一些电子转移给分子氧,产生用于PDT的化学荧光产物1O2。
2. M1CCD能有效地将M2巨噬细胞重新极化为M1表型
巨噬细胞一般分为2种类型:抗肿瘤M1细胞和促肿瘤M2细胞,而大多数肿瘤相关巨噬细胞(TAMs)属于免疫抑制型M2巨噬细胞。幸而,M1 EVs能够不断将M2巨噬细胞转化成M1巨噬细胞,不仅可以吞噬肿瘤细胞,而且可以有效地产生包括H2O2在内的活性氧(ROS),以便于CPPO顺利激活Ce6。为了确定M1CCD的重极化能力,将PBS(空白对照)、来自巨噬细胞的原始EVs(M0 EVs,阴性对照)、M1 EVs、M1CCD和LPS(阳性对照)分别与M2巨噬细胞孵育24小时。正如预期的是,经M1 EVs处理的细胞中M1协同刺激因子CD86(图3a)和抗肿瘤炎症因子IL-6、TNF-α(图3b)的表达显著提高,而M2巨噬细胞典型标志物CD206的表达降低,这表明M2巨噬细胞成功转化为M1巨噬细胞。值得注意的是M1CCD的重极化能力与M1 EVs和LPS相当。结果显示,M1 EVs、M1CCD和LPS处理组的H2O2浓度显著增加,M1CCD处理组的H2O2浓度相对较低可能是由于被CPPO迅速消耗(图3c)。近期,细胞形态的变化被视为巨噬细胞极化的可靠特征。作者也发现M2巨噬细胞形态较长,但是经M1CCD处理后细胞呈饼状。为了进一步研究M1CCD是否能够提高重极化巨噬细胞的吞噬能力,将经过不同处理的用CFSE标记的4T1肿瘤细胞与M2巨噬细胞共同孵育。随后,巨噬细胞用PE标记抗小鼠CD11b抗体染色,用激光共聚焦扫描显微镜(CLSM)成像。如图3d所示,经PBS和M0 EVs处理的M2巨噬细胞无法吞噬4T1肿瘤细胞,与之相反的是,经M1CCD、M1 EVs和LPS处理的M2巨噬细胞几乎吞噬了全部的4T1肿瘤细胞。结果显示,M1CCD处理组中85.3%的巨噬细胞PE染色和CFSE染色均呈阳性。总之,以上结果证明,M1CCD能够有效地重编程M2巨噬细胞,产生H2O2,为光动力疗法和免疫疗法提供可行性。
3.在M1 EVs中,CPPO和Ce6执行有效的PDT作用,并促进Dox-EMCH的释放
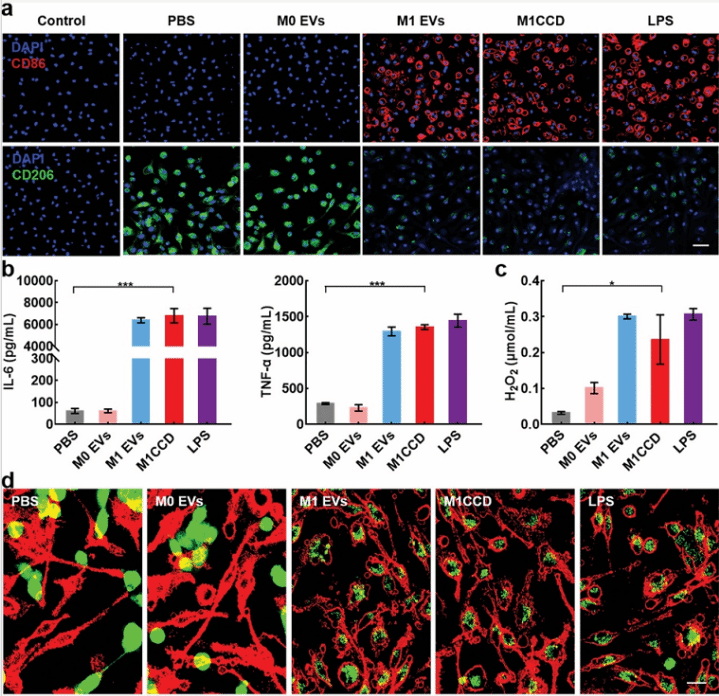
在这个化学激活的光动力疗法系统中,CPPO与H2O2反应产生高能中间产物-1,2-二氧杂环丁烷二酮,然后激活Ce6,将电子转移给分子氧,产生1O2。对应的,1O2的产生与H2O2的浓度紧密相关。众所周知,与正常细胞相比,肿瘤细胞通常产生更多的H2O2。为了估计肿瘤细胞相对正常细胞化学激活的1O2的产出,用PBS、M1@CPPO、M1@Ce6和M1CC分别处理4T1细胞和J774A.1细胞,用2',7'-二氯二氢荧光素(DCFH-DA)检测1O2的生成量。同预期一样,所有J774A.1细胞处理组均出现轻微的1O2荧光信号,经PBS、M1@CPPO和M1@Ce6处理的4T1细胞也出现轻微的荧光信号,但M1CC处理组显示出更亮的荧光信号,强度是PBS对照组的20倍。上述结果表明,由于激活状态Ce6的存在,1O2在H2O2充足的肿瘤细胞中可以特定地产出。因此,M1CC对正常细胞影响很小,而对4T1细胞有明显的细胞毒性,且呈剂量依赖性。而且,添加H2O2能够进一步增强细胞毒性。具体来说,经每毫升6.4×109颗粒的M1CC处理后,4T1细胞活力为43%,而添加100×10-6M H2O2后,细胞活力降到14%(图4a)。考虑到肿瘤微环境中存在许多M2巨噬细胞,且M1 EVs能够将M2巨噬细胞重极化为M1巨噬细胞,而使H2O2浓度明显增加,作者用一个体外Transwell模型进一步研究了M1CC诱导的4T1细胞凋亡。在该模型中,M2巨噬细胞在腔体顶部孵育,4T1细胞在腔体底部(图4b)。然后,将PBS、装载CPPO和Ce6的M0 EVs(M0CC)、M1CC分别加到模型的顶部和底部,孵育48小时以使顶部的M2巨噬细胞重极化为M1巨噬细胞,诱导底部PDT的化学激活。最后,用流式细胞术分析4T1细胞活力发现,M0CC处理后4T1细胞的凋亡总量为57.9%,M1CC处理组细胞凋亡量达76%,这表明,M1CC在特定的肿瘤微环境中能够展现出对PDT有效的影响。
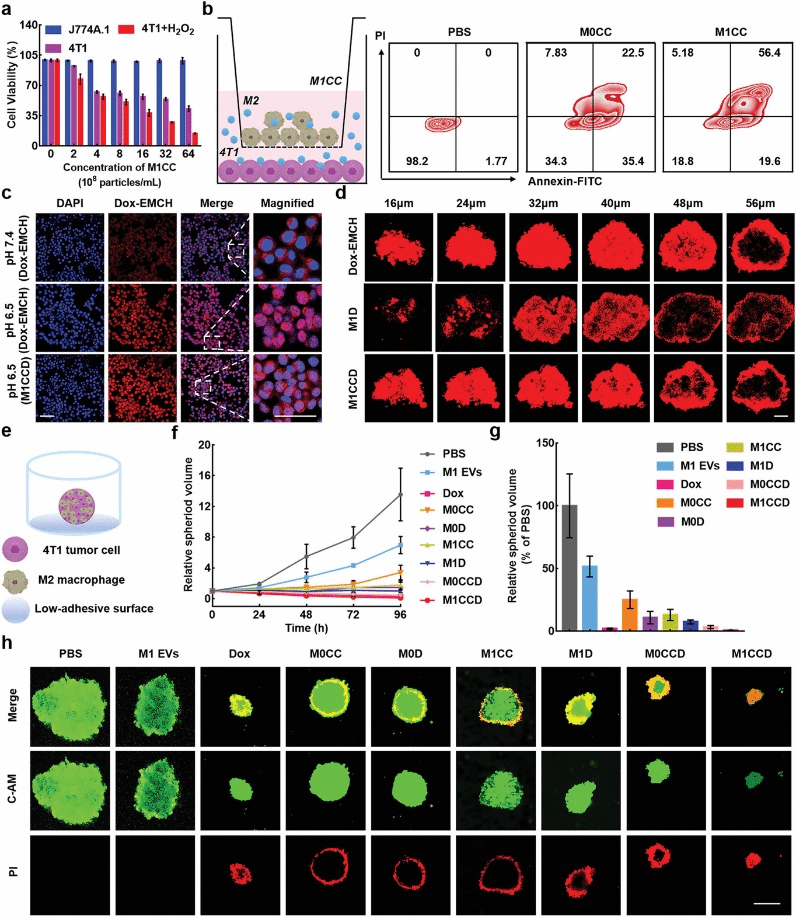
M1 EVs可以提高肿瘤微环境中的H2O2含量,进而增强化学激活PDT的效果。但这毫无疑问会受到肿瘤深处缺氧状态和纳米EVs低渗透性的限制。鉴于小分子药物具有强渗透性这一可行性,因此将化学疗法纳入到系统中进一步提高疗效。Dox-EMCH是源自阿霉素的腙类物质,分子中对酸敏感的腙连接体在微酸环境能够释放阿霉素。因此,在体外(包括人类)肿瘤微环境的pH6.5下,它展现出强烈的细胞毒性,但在pH7.4时对细胞影响较小。多细胞球(MCSs)模型结果明确表明,游离Dox-EMCH能够渗透到肿瘤组织深处。相反的是,与其他小分子相比,装载到M1 EVs中的Dox-EMCH(M1D)由于EVs巨大的体积使其渗透能力大大降低。有趣的是,与M1D相比,装载到M1CCD中的Dox-EMCH的渗透深度显著恢复,这可能是因为M1CCD能够在MCSs中有效地产生1O2,诱导M1 EVs胞膜破裂,释放Dox-EMCH(图4d)。
4. M1CCD主动靶向肿瘤组织并显示出有效的治疗功效
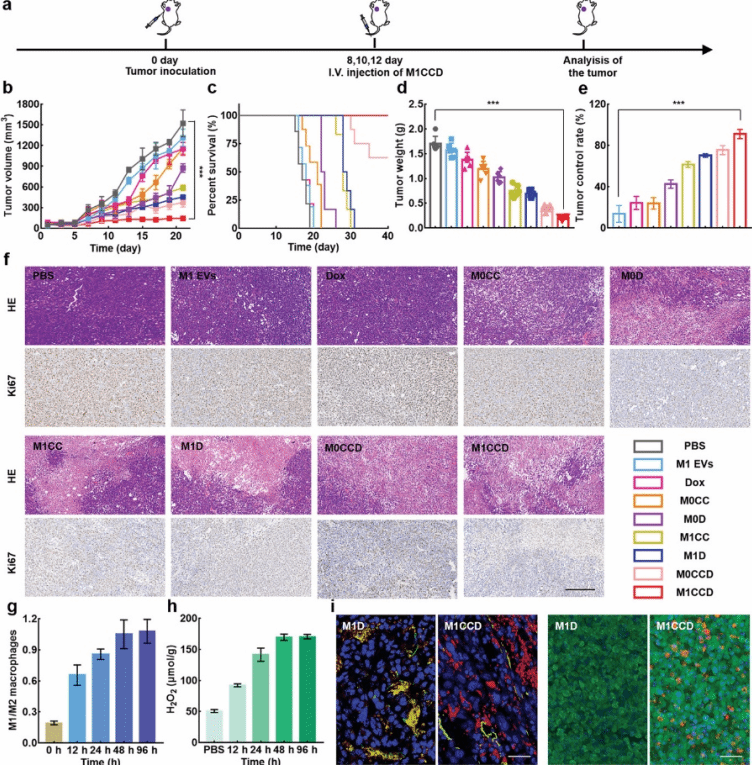
将4T1肿瘤模型小鼠分为9组,分别用不同制剂治疗,包括PBS、M1 EVs、Dox、M0CC、M0D、M1CC、M1D、M0CCD和M1CCD(图5a)。如图5b所示,M1 EVs和Dox轻微抑制肿瘤的生长,小鼠最终在21天内死亡。与M1 EVs、M0CC和M0D相比,由于免疫疗法与光动力疗法或者免疫疗法与化学疗法的协同作用,M1CC、M1D和M0CCD明显抑制了肿瘤的发育。值得注意的是,M1CCD处理组的肿瘤几乎被完全抑制,40天观察期内的存活率为100%(图5c)。不同处理组肿瘤平均重量也证明M1CCD的抗肿瘤效果最好(图5d)。M1CCD的肿瘤抑制率(以肿瘤体积计算)为91.6%,远高于M1 EVs(17%)、M1CC(61%)和M1D(70%)(图5e)。另外,H&E和Ki67染色结果表明,M1CCD处理组促进肿瘤细胞凋亡,抑制肿瘤细胞增生的能力最强(图5f)。
结 论
作者通过将CPPO、Ce6和Dox-EMCH装载到M1 EVs中,构建自激活的光-胞外囊泡,用于协同三模态抗癌治疗。给药后,获得的M1CCD能够通过M1 EVs天然的肿瘤归巢能力主动靶向肿瘤。因此,免疫疗法,光动力疗法和化学疗法以自激活和相互协同的方式,通过M1CCD与特殊的肿瘤微环境的相互作用,产生强大的抗癌效果和较小的副作用。未来研究团队将继续开发抗癌效果更好的治疗策略,比如增强M1 EVs的特定靶向能力,开发化学发光效率和PDT效应更强的新型光敏剂。
索莱宝产品亮点

相关产品
|
产品名称 |
产品货号 |
|
丙二醛(MDA)含量检测试剂盒 |
BC0020 |
|
丙二醛(MDA)含量检测试剂盒 |
BC0025 |
|
黄嘌呤氧化酶(XOD) 活性检测试剂盒 |
BC1090 |
|
黄嘌呤氧化酶(XOD) 活性检测试剂盒 |
BC1095 |
|
葡萄糖氧化酶(GOD) 活性检测试剂盒 |
BC0690 |
|
葡萄糖氧化酶(GOD) 活性检测试剂盒 |
BC0695 |
|
ANNEXIN V- FITC/PI 凋亡检测试剂盒 |
CA1020 |
|
Hoechst 33342/PI 双染试剂盒 |
CA1120 |
备注
索莱宝生化试剂盒货号以“0”、“5”结尾,分别代表两类反应体系。以“0”结尾的代表试剂盒所用方法为分光光度法(反应体系约1mL),可以用分光光度计进行检测;以“5”结尾的试剂盒代表所用方法为微量法(反应体系约0.2mL),可以用分光光度计或者酶标仪进行检测。