|


| 产地 | 北京 |
| 品牌 | Solarbio |
| 货号 | SEKM-0004 |
| 用途 | |
| 检测方法 | 双抗体夹心法 |
| CAS编号 | |
| 检测限 | |
| 数量 | 10 |
| 包装规格 | |
| 标记物 | 小鼠 |
| 纯度 | % |
| 样本 | 血清、血浆或细胞培养上清液等样本 |
| 应用 | Elisa |
中文名称 小鼠白介素2检测试剂盒 英文名称 Mouse IL-2 ELISA KIT 反应性 Mouse 样品类型 Serum, plasma, Cell culture supernatant 灵敏度 4 pg/ml 检测目标 IL-2 应用 Sandwich ELISA
背景介绍:
白细胞介素2(IL-2)是一种在机体免疫应答中扮演重要角色的多效性细胞因子。其于1976年被Morgan在小鼠脾细胞培养上清中发现,由于它能很好地促进和维持T细胞长期培养, 故将其称之为为T细胞生长因子,1979年统一命名为IL-2。小鼠IL-2含有133个氨基酸残基,分子量为15.5kDa。IL-2最重要的作用是诱导T淋巴细胞增殖和分化,此外,IL-2还可调节多种细胞的免疫应答。在体内,IL-2有抗肿瘤、抗微生物感染、引起移植排斥和自身免疫以及免疫调节等作用。
检测原理:
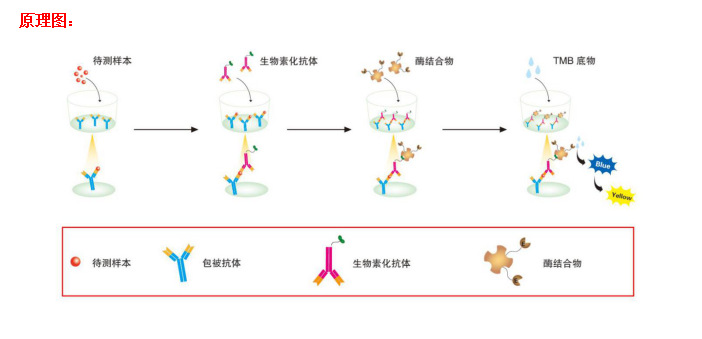
Solarbio (Solarbio ®)ELISA试剂盒采用基于双抗体夹心法的酶联免疫吸附检测技术。将抗小鼠IL-2单克隆抗体包被在酶标板上;分别加入梯度稀释的标准品和预稀释的样本,标准品和样本中的小鼠IL-2会与酶标板上的包被抗体充分结合;洗板后加入生物素化抗小鼠IL-2抗体,该抗体会与板子上包被抗体捕获的标准品和样本中的小鼠IL-2发生特异性结合;洗板后加入辣根过氧化物酶(HRP)标记的链霉亲和素,生物素与链霉亲和素会发生高强度的非共价结合;洗板后加入显色剂底物TMB,若反应孔中样品存在不同浓度的小鼠IL-2,则HRP会使无色TMB变成不同深浅(正相关)的蓝色物质,加入终止液后反应孔会变成黄色;*,在λmax=450 nm(OD=450 nm)处测定反应孔样品吸光度(OD),样本中的小鼠IL-2浓度与OD成正比,通过绘制标准曲线和四参数拟合软件便可计算出样本中小鼠IL-2的浓度。
注意事项:※※※
1. 试剂盒应在有效期内使用,请不要使用过期的试剂。
2. 试剂盒未使用时应保存在2-8℃冰箱,已复溶但未用完的标准品,请丢弃。
3. 试剂盒使用前请在室温恢复30 min,且充分混匀试剂盒里的各种成份及制备的样品。
4. 在试验中标准品和样本建议作复孔检测,且加入试剂的顺序应保持一致。
5. 为避免交叉污染,请在试验中使用1次性试管,枪头,封板膜(※)及洁净塑料容器。.
6. 浓缩生物素化抗体和浓缩酶结合物的体积较少,在运输过程中微量液体会沾到管壁及瓶
盖上,使用前请离心处理(5-10 S即可),使管壁上的液体集中在管底部,取用时,请用移液器小心吹打几次。
7. 除了试剂盒中的浓缩洗涤液和终止液可以通用外,请不要使用其他来源试剂盒内含的试
剂代替本试剂盒中的某单个组分。
8. 为保证结果准确,每次检测均需做标准曲线。
安全提示:试剂盒中的终止液为酸性溶液,操作人员在使用时请带上手套并注意防护;在操作过程中也要避免试剂接触皮肤和眼睛,如果不慎接触,请用大量清水清洗;检测血液样本及其它体液样本时,请按国家生物实验室安全防护有关管理规定执行。
试剂盒组成及储存:
试剂盒组成 | 规格(96T) | 规格(48T) | 保存条件 |
抗体预包被酶标板 | 8*12 | 8*6 | 2-8℃ |
标准品 | 2支 | 1支 | -20 ℃ |
标准品/样本稀释液(SR1) | 16 ml/瓶 | 8 ml/瓶 | 2-8℃ |
浓缩生物素化抗体 | 120 ul(100X) | 60 ul(100X) | 2-8℃ |
抗体稀释液(SR2) | 16 ml/瓶 | 8 ml/瓶 | 2-8℃ |
浓缩酶结合物(避光) | 120 ul(100X) | 60 ul(100X) | 2-8℃ |
酶结合物稀释液(SR3) | 16 ml/瓶 | 8 ml/瓶 | 2-8℃ |
浓缩洗涤液 (20×) | 30 ml/瓶 | 15 ml/瓶 | 2-8℃ |
显色底物(避光) | 12 ml/瓶 | 6 ml/瓶 | 2-8℃ |
终止液 | 12 ml/瓶 | 6 ml/瓶 | 2-8℃ |
封板胶纸 | 4张 | 2张 | |
说明书 | 1份 | 1份 |
自备实验器材(不提供,可代购)
1. 酶标仪(主波长450nm,参考波长630nm)
2. 高精度移液器及一次性吸头:0.5-10,2-20,20-200,200-1000μl
3. 洗板机或洗瓶
4. 37℃孵育箱
5. 双蒸水,去离子水,量筒等
6. 稀释用聚丙烯试管
样本收集及储存:
1. 细胞培养上清:
将细胞培养基移至无菌离心管,在4℃条件下1000×g离心10 min,然后将上清等量分装于小EP管并于-20℃下保存(24小时内检测可放入2-8℃储存),避免反复冻融。
2. 血清样本:
室温血液自然凝固20 min后,在4℃条件下1000×g离心10 min,然后将上清等量分装于小EP管并于-20℃下保存(24小时内检测可放入2-8℃储存),保存过程中如有沉淀,请再次离心,避免反复冻融。
3. 血浆样本:
将全血收集到含抗血凝剂的管中,根据标本的实际要求选择EDTA,柠檬酸钠或肝素作为抗凝剂,混合20 min,在4℃条件下1000×g离心10 min,然后将上清等量分装于小EP管并于-20℃下保存(24小时内检测可放入2-8℃储存),避免反复冻融。
※注意:血清血浆样本避免使用溶血、高血脂样本,以免影响检测结果;如果样本中的靶标物检测浓度高于标准品的*值,请将样品做适当倍数稀释后检测,建议正式实验前做预实验以确定稀释倍数。
试剂准备:
1. 试剂回温:首先在实验前30 min将试剂盒,待测样本放置于室温下,浓缩洗涤液如出现结晶,请放入37℃温浴直到结晶全部溶解。
2. 配制洗涤液:预先计算好稀释后的洗涤液使用体积,然后用双蒸水或去离子水将20倍浓缩洗涤液稀释成1倍应用液,未用完的浓缩洗涤液放入4℃冰箱保存。
3. 标准品梯度稀释:加入标准品/样本稀释液(SR1)1ml至冻干标准品中,静置15分钟待其完全溶解后轻轻混匀(浓度为1000pg/ml),然后按照以下浓度:1000、 500、 250、125、62.5、31.25、15.625、 0 pg/ml进行稀释。复溶过的标准品原液(1000pg/ml)未用完的应废弃或根据需要按照一次用量分装,并将其贮存在-20~-80℃冰箱,具体如下图。

1. 生物素化抗体工作液:预先计算好试验所需用量,用检测稀释液(SR2)将100倍抗体浓缩液稀释成1倍应用工作液(稀释前充分混匀),请在30分钟内加入到反应孔中。
生物素化抗体工作液具体稀释方法如下:
板条 | 浓缩生物素化抗体(1:100):μL | 检测稀释液(SR2):μL |
2 | 20 | 1980 |
4 | 40 | 3960 |
6 | 60 | 5940 |
8 | 80 | 7920 |
10 | 100 | 9900 |
12 | 120 | 11880 |
2. 酶结合物工作液:按每次试验所需用量配制,用酶结合物稀释液(SR3)将100倍浓缩酶结合物稀释成1倍应用工作液(稀释前离心),请在30分钟内使用。
酶结合物工作液具体稀释方法如下:
板条 | 浓缩酶结合物(1:100):μL | 检测稀释液(SR3):μL |
2 | 20 | 1980 |
4 | 40 | 3960 |
6 | 60 | 5940 |
8 | 80 | 7920 |
10 | 100 | 9900 |
12 | 120 | 11880 |
3. 洗涤方法:
l 自动洗板:甩尽酶标板孔中液体,在厚迭吸水纸上拍干,注入洗涤液为300ul/孔,注与吸出间隔为30秒,洗板5次。
l 手工洗板:甩尽酶标板孔中液体,在厚迭吸水纸上拍干,用洗瓶加入洗涤液300ul/孔,静止30秒后甩净酶标板孔中液体,在厚迭的吸水纸上拍干,洗板5次。

结果判断:
1.用酶标仪 450 nm 波长测定 OD 值。选择双波长检测,参考波长为 630 nm。如不能进行双波长检测,请用 450 nm 的OD测定值减去630 nm的OD测定值。
2.计算标准品、样品的平均OD值:每个标准品和标本的OD值应减去零孔的OD值
3.以标准品浓度为横坐标,吸光度OD值为纵坐标,用软件绘制标准曲线,样品中IL-2含量可通过对应OD值由标准曲线换算出相应的浓度。
4.若标本OD值高于标准曲线上限,应做适当稀释后重新检测,计算浓度时再乘以稀释倍数。
参数表征:
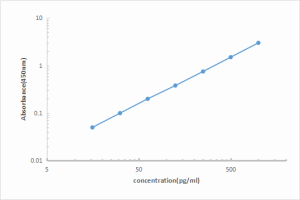
1. 数据及标准曲线
标准品浓度(pg/ml) | OD值1 | OD值2 | 平均值 | 矫正值 |
0 | 0.071 | 0.073 | 0.072 | --- |
15.625 | 0.116 | 0.120 | 0.118 | 0.046 |
31.25 | 0.261 | 0.225 | 0.243 | 0.171 |
62.5 | 0.352 | 0.379 | 0.365 | 0.293 |
125 | 0.508 | 0.486 | 0.497 | 0.425 |
250 | 0.852 | 0.826 | 0.839 | 0.767 |
500 | 1.436 | 1.458 | 1.447 | 1.375 |
1000 | 2.426 | 2.503 | 2.464 | 2.392 |
本图仅供参考,应以当次试验标准品绘制的标准曲线计算小鼠IL-2的样本含量
2. 灵敏度:
*可检测小鼠IL-2浓度达7pg/ml,
20个零标准品浓度OD的平均值加上两个标准差,计算相应的可检测浓度。
3. 特异性:
不与小鼠IL-2、4、6、8、10反应,大鼠IL-2、4、6、8等反应
4. 重复性:
板内,板间变异系数<10%
5. 回收率:
在选取的健康小鼠血浆、细胞培养上清中加入 3 个不同浓度水平的小鼠 IL-2,计算回收率。
样本类型 | 平均回收率(%) | 范围(%) |
血浆 | 85 | 82-106 |
细胞培养上清 | 93 | 90-104 |
6. 线性稀释:
分别在选取的4 份健康小鼠血浆和细胞培养上清中加入高浓度小鼠 IL-2,在标准曲线动力学范围内进行稀释,评估线性。
稀释比例 | 回收率(%) | 血浆 | 细胞培养上清 |
1:2 | 平均回收率(% ) | 93 | 105 |
范围(%) | 82-99 | 90-109 | |
1:4 | 平均回收率(% ) | 92 | 108 |
范围(%) | 86-103 | 95-114 | |
1:8 | 平均回收率(% ) | 103 | 96 |
范围(%) | 92-111 | 91-102 | |
1:16 | 平均回收率(% ) | 102 | 104 |
范围(%) | 89-104 | 86-117 |
参考文献:
1. Yokota, T. et al. (1985) Proc. Natl. Acd. Sci. USA 82:68.
2. Kashima, N. et al. (1985) Nature 313:401.
3. Fuse, A. et al. (1984) Nucl. Acids Res. 12:9323.
4. Thomas, R. et al. (2003)J Leukocyte Bio. 961-965
5. Bronte, V. et al. (1995) J. Immunol.5282-5292
6. Yokota, T. et al. (1985) Proc. Natl. Acad. Sci. USA 82:68.
7. Kashima, N. et al. (1985) Nature 313:401.
常见问题及解决方法:
问题 | 可能原因 | 解决方法 |
高背景或阴性对照值偏高 | 洗板不充分 | 将洗涤液注入反应孔充分洗涤,彻底拍干孔中液体 |
酶结合物过量 | 检查酶稀释度,按说明书标识的稀释度稀释 | |
底物污染 | 加底物前检查底物是否为透明无色,请勿用变蓝的底物,重新用新的底物试验 | |
阴性对照孔被阳性对照污染 | 注意洗涤时不要把洗液溢出孔外,不使阴阳对照孔液体涟接一起 | |
不同批次试剂混用 | 检查试剂批号,请勿用不同批次试剂 | |
显色信号弱 | 试剂过期 | 检查试剂盒有效期,请勿用过期试剂 |
孵育时间过短 | 按说明书中规定的时间孵育 | |
试剂污染 | 检查试剂是否污染,请勿用污染的试剂 | |
酶标仪滤光片不匹配 | 检查酶标仪设置及滤光片是否匹配 | |
试剂盒平衡不充分 | 确保试剂盒试验前平衡至室温 | |
显色时间不够 | 增加底物显色时间 | |
无显色信号 | 检测抗体、酶、或显色剂漏加 | 检查试验操作流程,重复试验 |
酶被叠氮钠污染 | 请使用重新配制的试剂 | |
试剂添加顺序有误 | 检查复核试验添加顺序、流程,重复试验 | |
标曲佳但样品孔无信号 | 样品中靶标物含量低或样品中无靶标物 | 设置阳性对照,重复实验 |
样品基质效应影响检测 | 重新稀释样品后复测 | |
标曲佳但样品信号偏高 | 样品中待检物含量超过标准曲线范围 | 重新稀释样品后复测 |
边缘效应 | 孵育温度不均衡 | 孵育时每步均使用新的封板胶纸,避免在环境温度变化大的地方孵育,勿叠放反应板 |